Estudo científico publicado na Revista Nature
Abstrato
O efeito dos glóbulos vermelhos (RBC) expostos a um campo eletromagnético (EMF) de 18 GHz foi estudado. Os resultados deste estudo demonstraram pela primeira vez que a exposição de hemácias a CEM de 18 GHz tem a capacidade de induzir a captação de nanoesferas em hemácias. A captação de nanoesferas (eficiência de carregamento de 96% e 46% para nanoesferas de 23, 5 e 46, 3 nm, respectivamente), sua presença e localização foram confirmadas usando três técnicas independentes, nomeadamente microscopia eletrônica de varredura, microscopia confocal de varredura a laser e microscopia eletrônica de transmissão. Pareceu que as nanoesferas de 23,5 nm foram translocadas através da membrana para o citosol, enquanto as nanoesferas de 46,3 nm foram translocadas principalmente através da bicamada fosfolipídio-colesterol, com apenas algumas dessas nanosferas passando pela rede do citoesqueleto 2D. A absorção de nanoesferas aumentou em até 12% com o aumento da temperatura de 33 para 37 °C. A análise TEM revelou que as nanoesferas foram engolfadas pela própria membrana celular e depois translocadas para o citosol. Acredita-se que os dipolos de água rotativos induzidos por EMF causaram perturbação da membrana, iniciando a sua deformação e resultando num grau aumentado de tráfego de membrana através de um processo de quase exocitose.
Introdução
Os efeitos dos campos eletromagnéticos (EMFs) sobre os genes 1 , 2 , 3 , 4 , 5 , proteínas e cinética enzimática 6 , 7 , 8 , 9 , 10 em nível molecular foram reconhecidos e investigados. Os mecanismos responsáveis por esses efeitos induzidos por CEM não são totalmente compreendidos e têm sido objeto de debate 4 , 6 , 8 , 11 , 12 , 13 , 14 , 15. Pensa-se que os efeitos dos CEM são diversos e dependem da força, frequência e duração das exposições aos CEM 15 , 16 . Os efeitos de microondas EMF em frequências de GHz foram estudados recentemente e foi relatado que múltiplas exposições a EMF de 18 GHz, com valores de taxa de absorção de energia específica (SAR) entre aproximadamente 3,0 e 5,0 kW kg-1, induziram permeabilização de células bacterianas vivas e leveduras . A captação de dextrana de alto peso molecular (150 kDa) e nanopartículas de sílica (23,5 e 46,3 nm de diâmetro) foi demonstrada para vários tipos de células, incluindo os organismos procarióticos Branhamella catarrhalis, Escherichia coli, Kocuria rosea, Planococcus maritimus, Staphylococcus aureus , Staphylococcus epidermidis, Streptomyces griseus e uma levedura eucariótica unicelular Saccharomyces cerevisiae 14 , 17 , 18 .
À luz dessas descobertas, o objetivo desta pesquisa foi determinar se a exposição a CEM de 18 GHz induz a permeabilidade celular nos glóbulos vermelhos (RBCs). Compreender se a permeabilidade dos eritrócitos induzida por CEM pode ser alcançada é de particular interesse no contexto da preservação de eritrócitos, liofilização, bem como de um ponto de vista fundamental para induzir pinocitose e endocitose em eritrócitos, para alvos de eritrócitos. plataformas de distribuição de medicamentos 19 . Este interesse surge porque os eritrócitos são biocompatíveis, biodegradáveis, de natureza não imunogênica e menos propensos à agregação e fusão 20 , 21. Para atingir o sistema reticuloendotelial ou para reduzir a extensão das reações alergênicas, materiais exógenos e/ou medicamentos podem ser protegidos do ambiente extracelular por encapsulamento nas hemácias 21 , 22 . A membrana plasmática das hemácias pode proteger os medicamentos encapsulados da inativação com uma vida útil prolongada e controlável 20,21 . As abordagens atuais para a produção de hemácias que contêm drogas encapsuladas exploram as técnicas de difusão osmótica e eletroporação devido ao efeito mínimo que esses processos têm na estrutura e morfologia das hemácias 22. Assim, se um grau de permeabilidade celular, semelhante ao descrito acima para outras linhas celulares, puder ser alcançado em hemácias através da exposição a campos eletromagnéticos de 18 GHz, isso ofereceria um meio adicional e potencialmente importante de administração de medicamentos.
Resultados e discussão
A morfologia dos glóbulos vermelhos
A morfologia das hemácias que foram submetidas a CEM a 33 e 37 °C foi examinada para confirmar que a exposição a CEM não causa morte fisiológica das hemácias. A análise das imagens SEM mostrou que as hemácias tratadas com EMF preservaram sua morfologia original sem diferença estatisticamente significativa em comparação aos controles ( p > 0,05). Apenas 9 ± 1% e 14 ± 1% (a 33 e 37 ° C, respectivamente) dos eritrócitos expostos a CEM transformaram-se em vesículas e acantócitos, respectivamente (Fig. 1, linha superior ) . De acordo com relatórios anteriores, a esferização, a fragmentação parcial e a vesiculização dos glóbulos vermelhos podem ser resultado de membrana lipídica danificada e/ou proteínas esqueléticas, como a espectrina 23 , 24 , 25. Anteriormente, as alterações morfológicas em hemácias humanas tratadas termicamente eram registradas a 44°C 26 , enquanto 49°C era considerada a temperatura crítica para a fragmentação de hemácias 26 . Como tal, a temperatura global na faixa de 33 a 37 °C por si só não deve afetar a morfologia dos glóbulos vermelhos. De fato, pode ser visto na Fig. 1 que a morfologia dos eritrócitos não tratados e tratados termicamente com Peltier nos grupos de controle permaneceu inalterada (Fig. 1) ., segunda e terceira linhas). Assim, a mudança na morfologia das hemácias expostas aos CEM é uma manifestação da mudança na relação área/volume, que por sua vez reflete as alterações microscópicas na elasticidade da membrana e/ou na pressão osmótica local. Verificou-se também que aproximadamente 1,5% da água total presente evaporou das amostras durante as exposições a CEM, o que foi considerado insignificante e não deve afetar a pressão osmótica geral.
Morfologia dos glóbulos vermelhos após exposição a um CEM de 18 GHz. Micrografias SEM típicas de hemácias de coelho após exposição à radiação EMF de 18 GHz, em temperaturas de até 33 e 37 °C. Aproximadamente 9% (33 °C) e 14% (37 °C) de vesículas de hemácias (primeira linha) e acantócitos (primeira linha) foram observadas. A morfologia dos eritrócitos de controlo não tratados e tratados termicamente com Peltier permaneceu inalterada na sua morfologia (segunda e terceira filas). As barras de escala são 10 μm.
Absorção de nanosferas induzida por EMF
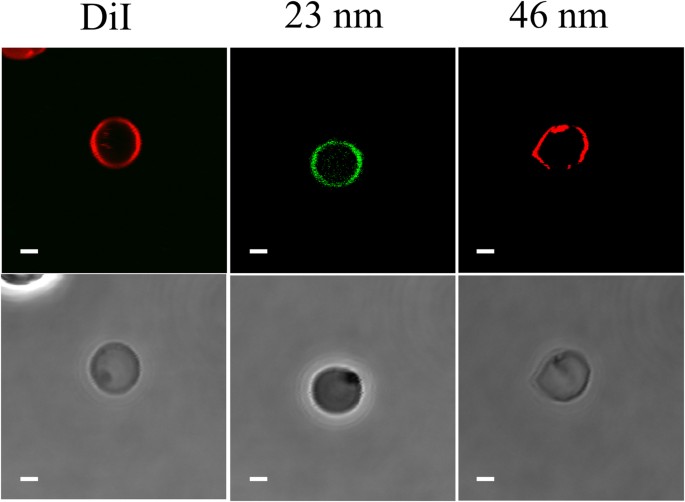
A análise de microscopia confocal de varredura a laser (CLSM) e microscopia eletrônica de transmissão (TEM) de hemácias expostas ao EMF mostrou que o EMF induziu permeabilidade na membrana das hemácias, conforme confirmado pela absorção de nanoesferas de sílica de dois tamanhos diferentes (Figs. 2 – 3 ). Houve diferenças estatisticamente significativas entre as hemácias expostas aos CEM e as amostras de controle ( p < 0,05). As nanoesferas de sílica foram escolhidas para este estudo porque são hidrofílicas e, portanto, não atravessam espontaneamente a bicamada lipídica 27 ; os tamanhos de 23,5 nm e 46,3 nm foram escolhidos para serem menores que o tamanho de malha da espectrina 25 , 28; também foi relatado que a superfície com carga neutra das nanopartículas evita quaisquer interações inespecíficas que ocorram dentro da membrana 29 . Assim, este tipo de nanosfera poderia ser utilizado como grupo de controle negativo. Os resultados obtidos para os eritrócitos Peltier aquecidos e não tratados confirmaram que em ambos os casos, nenhuma nanoesfera foi levada para a membrana celular (Fig. 4 ), o que exclui a mudança de temperatura global como a causa (não houve diferença estatisticamente significativa entre o EMF e amostras controle, p > 0,05). Contudo, o efeito da elevação localizada instantânea da temperatura (T i ) 30 não pode ser descartado como uma causa potencial. Isso ocorre porque T eupode ser maior que a temperatura ambiente (T B ) para satisfazer a equação de Arrhenius ( ![]() , onde EA é a energia de ativação, R é a constante do gás e T é a temperatura) 30 , o que significa que é possível que T i tenha diferido entre as condições EMF e da placa Peltier. Esta possibilidade não pode ser determinada a partir do presente estudo porque T i é uma função da entrada de energia EMF e não é diretamente mensurável devido à sua curta existência e natureza molecular 30 .
, onde EA é a energia de ativação, R é a constante do gás e T é a temperatura) 30 , o que significa que é possível que T i tenha diferido entre as condições EMF e da placa Peltier. Esta possibilidade não pode ser determinada a partir do presente estudo porque T i é uma função da entrada de energia EMF e não é diretamente mensurável devido à sua curta existência e natureza molecular 30 .
Permeabilização de hemácias resultante da exposição a um CEM de 18 GHz. As imagens CLSM mostram uma absorção de nanoesferas de 23,5 e 46,3 nm (primeira linha). Uma coloração de membrana lipofílica, DiI (Life Technologies, Scoresby, VIC, Austrália) foi usada para corar toda a população de hemácias para fins de contraste (primeira linha). As imagens de contraste de fase (segunda linha) mostram eritrócitos no mesmo campo. As barras de escala são 2 μm.
Internalização de nanoesferas de 46,3 nm nas hemácias expostas a EMF. Imagens típicas de TEM de seções transversais ultrafinas (70 nm) de hemácias expostas a EMF, mostrando a internalização de nanoesferas de 46,3 nm. As hemácias expostas ao CEM e deixadas atingir uma temperatura de 37 °C foram capazes de internalizar um número maior de nanoesferas do que aquelas expostas ao CEM a um máximo de 33 °C. As barras de escala são 0,5 μm (segunda linha). As barras de escala inseridas são 200 nm (primeira linha).
Não houve captação de nanoesferas de 23,5 e 46,3 nm pelos grupos controle. Imagens CLSM e contraste de fase mostrando a aparência das hemácias permanecendo inalterada e sem internalização de nanoesferas. As barras de escala são de 2 μm (primeira e segunda linhas). Imagens típicas de TEM de seções transversais ultrafinas (70 nm) de hemácias, mostrando a membrana celular de hemácias não tratadas e tratadas termicamente com um citosol uniforme sem a presença de nanoesferas de 46,3 nm. As barras de escala são 1 μm (quarta linha). As barras de escala inseridas são 200 nm (terceira linha).
A análise CLSM também indicou que a internalização das nanoesferas poderia continuar por aproximadamente 9 minutos após a irradiação EMF (dados não mostrados); enquanto nenhuma absorção das nanoesferas foi detectada quando as hemácias foram expostas às nanoesferas 10 minutos após a irradiação EMF. Este resultado indicou que as células permaneceram permeáveis durante 9 min, de acordo com observações previamente relatadas para outros tipos de células 14 , 17 , 18 .
Verificou-se ainda aqui que a eficiência de carregamento das nanoesferas de 23,5 nm foi superior a 96% para condições de temperatura de 33 e 37 °C, sem diferença estatisticamente significativa (p > 0,05). A eficiência de carregamento das nanoesferas de 46,3 nm foi, no entanto, de 46 e 58% para amostras submetidas a temperaturas de 33 e 37°C, respectivamente (Tabela Suplementar S1 ). No geral, o número de hemácias que foram capazes de internalizar as nanoesferas de 46,3 nm aumentou (até 12% do total de hemácias) quando a temperatura foi aumentada de 33 para 37°C com uma diferença estatisticamente significativa (p <0,05) (Tabela Suplementar S1), o que pode indicar alterações na membrana celular e na rede de espectrinas como resultado do aumento da temperatura. Além disso, nas amostras que foram submetidas às temperaturas de 33 °C e 37 °C durante exposições a CEM, estimou-se que um único eritrócito internalizava 6 e 10 fg adicionais das nanosferas de 23,5 e 46,3 nm, respectivamente, com uma diferença estatisticamente significativa. p <0,05) (Tabela Suplementar S1 ). Deve-se notar que apenas as hemácias com morfologia circular nas imagens de contraste de fase foram contadas para a quantificação da eficiência de carregamento (Figura Suplementar S1 ). Os resultados obtidos neste trabalho em relação à internalização de hemácias dependente da temperatura estavam de acordo com as observações relatadas por Harisa, et al . 31. Esses autores relataram que um maior grau de carga de hemácias humanas com a droga pravastatina ocorreu a 37 °C em comparação com aquele obtido a 25 °C.
Uma análise TEM das seções transversais ultrafinas (70 nm) das hemácias revelou a localização intracelular e os estágios da translocação da nanoesfera. Pode-se observar nas micrografias TEM que as nanoesferas internalizadas, embora estivessem próximas da membrana, pareciam ser engolfadas pela própria membrana celular e depois translocadas para o citosol (Fig. 3, indicada pelas setas ) . Também havia aglomerados visíveis de nanoesferas presas dentro da membrana. Verificou-se também, no entanto, que as nanoesferas de 23, 5 nm foram capazes de atravessar a rede de espectrina 2D para o citosol (Fig. Suplementar S2 , indicada pelas setas). Verificou-se que os eritrócitos não tratados e aquecidos com placa Peltier nos grupos de controle não possuíam quaisquer nanoesferas internalizadas (Fig. 4 ).), destacando a falta de permeabilidade celular nessas amostras.
Deve-se notar que as grandes nanoesferas translocadas frequentemente permaneciam próximas da membrana no interior das hemácias (Fig. 3 ). As nanoesferas de 46,3 nm provavelmente ficaram presas entre a membrana e a rede do citoesqueleto, que está localizada abaixo da membrana das hemácias. Isto pode ser devido à organização única da membrana celular dos eritrócitos 32 . A bicamada assimétrica fosfolipídio-colesterol, composta por fosfatidilserina, é enriquecida no folheto interno 33 . Abaixo da bicamada fosfolipídio-colesterol há um citoesqueleto bidimensional (2D) com aproximadamente 7,9 nm de espessura 28. Essa rede do citoesqueleto está ancorada na bicamada fosfolipídica, que possui as dimensões de uma malha de aproximadamente 162 nm × 65 nm (comprimento × largura) 25 , 28 . O citoesqueleto 2D consiste em heterodímeros de espectrina e feixes de actina e está envolvido no processo de regulação do volume celular 25 . Esta rede esquelética permite que os glóbulos vermelhos sofram deformações extensionais significativas, mantendo a sua integridade estrutural 34 . Os resultados obtidos neste trabalho sugeriram que, embora as nanoesferas de 46,3 nm pudessem ser translocadas através da bicamada fosfolipídio-colesterol, apenas as nanoesferas de 23,5 nm poderiam passar pela rede 2D do citoesqueleto.
Assim, foi demonstrado que três exposições consecutivas a EMF de 18 GHz, cada uma de 1 min com SAR de aproximadamente 3,0 kW · kg -1 (a 33 ° C), induziram consistentemente a permeabilização da membrana nas hemácias sem comprometer a viabilidade das células. Por ser um campo de alternância rápida, o CEM de 18 GHz atua diretamente sobre os dipolos de água, induzindo sua rotação e reorientação, sendo o atraso de polarização responsável pela dissipação de energia e aquecimento 35 , 36 . A rotação das moléculas de água perturba a rede de ligações de hidrogênio e, portanto, afeta, entre outros, a constante dielétrica da água 35 , 36. A dissipação de energia em massa próxima às membranas pode afetar a estabilidade da membrana. Essa mudança na atividade pode induzir a perturbação da membrana celular, tornando as células mais permeáveis e sensíveis à deformação da membrana 37 , 38 , 39 , 40 , 41 . A perturbação mecânica induzida por EMF pode alterar a permeabilidade da tensão da membrana e, assim, um maior grau de tráfego da membrana através da bicamada lipídica. A membrana permaneceu permeável por aproximadamente nove minutos e depois foi restaurada ao seu estado original após 10 minutos, como foi confirmado para diferentes tipos de células 14 , 17 , 18. Isto pode ser devido a longos processos de relaxamento nas membranas lipídicas após perturbação mecânica. Foi relatado que os eritrócitos podem sofrer invaginação da sua membrana celular, que pode então ser “comprimida” e selada, formando vacúolos intracelulares 42 . Essa internalização da membrana celular lembra a pinocitose observada em outros tipos celulares 42 . Ginn et al . sugeriram que esse processo de invaginação resultaria em uma diminuição na área superficial das membranas celulares sob tensão, reduzindo assim o volume hemolítico crítico da célula 42. As consequências da internalização da membrana são, portanto, semelhantes às produzidas pela fragmentação, na medida em que ambos os processos resultarão numa diminuição da área global da membrana da superfície celular 42 .
Os resultados deste estudo demonstraram, pela primeira vez, que a exposição de hemácias a CEM de 18 GHz tem a capacidade de induzir a permeabilidade celular sem comprometer a viabilidade celular. Este efeito não foi encontrado na condição de controle de aquecimento Peltier, o que mostra que não foi devido ao aumento da temperatura global, no entanto, se mudanças de temperatura mais localizadas espacialmente e temporalmente podem ser responsáveis pelo efeito não pode ser determinado a partir do presente estudo. Após a exposição aos CEM, acredita-se que as membranas dos glóbulos vermelhos se tornem permeáveis devido à perturbação mecânica da membrana. Acreditamos que a captação de nanopartículas induzida por CEM é um fenômeno único e universal, porque diversos tipos de células poderiam ser igualmente afetados de maneira semelhante. A elucidação do(s) mecanismo(s) molecular(es) da permeabilidade induzida por CEM exigirá investigação adicional.
Material e métodos
Nanoesferas de sílica
Dois tipos de nanoesferas de sílica fluorescentes, 23,5 ± 0,2 nm (FITC) e 46,3 ± 0,2 nm (Rodamina B) de diâmetro, adquiridas da Corpuscular, Cold Spring, NY, EUA.
Isolamento de hemácias
Os eritrócitos foram isolados do sangue fresco de um coelho branco da Nova Zelândia com 16 semanas de idade, de acordo com o método aprovado pelo Monash Animal Ethics Committee (Physiology, Monash University, Austrália). O sangue total foi colocado em tubos plásticos Vacutainer, revestidos por spray com K 2EDTA (Becton Dickinson, Sparks, NV, EUA) e invertido diversas vezes para evitar a coagulação sanguínea. Os tubos Vacutainer foram então desinfetados com etanol a 70%. Todos os procedimentos experimentais foram realizados dentro de uma cabine de biossegurança classe II (Thermo Fisher Scientific, Waltham, Massachusetts, EUA) de acordo com a aprovação obtida do Comitê de Biossegurança de Swinburne (Swinburne Research, Swinburne University of Technology, Austrália). O sangue fresco foi então homogeneizado suavemente com uma solução salina tampão fosfato (PBS) 10 mM a pH 7,4 e numa proporção de 1:1. Em um tubo Falcon (Becton Dickinson), a mistura sanguínea foi então cuidadosamente colocada sobre uma solução Histopaque 1077 (Sigma Aldrich, St. Louis, Missouri, EUA) na proporção de 3:1 e depois centrifugada a 400 g por 20 min. A camada de hemácias no fundo do tubo Falcon foi recuperada e lavada duas vezes em solução PBS 1,0 mM a pH 7,4, depois centrifugada a 400 g por 5 min. A densidade celular foi então ajustada para 5 × 105 células mL −1 em PBS usando um hemocitômetro aprimorado por Neubauer (Paul Marienfeld, Lauda-Königshofen, Alemanha). Esta concentração permitiu que a energia EMF fosse distribuída uniformemente entre os glóbulos vermelhos e a capacidade térmica específica da suspensão celular fosse aproximadamente equivalente à da água a 25 °C.
Dosimetria
A dose de CEM que foi entregue às amostras de hemácias é expressa como a taxa de absorção específica (SAR, kW/kg), conforme descrito em outro local 17 , 18 , 43 . Resumidamente, a SAR foi medida partindo do pressuposto de que toda a energia de campo absorvida foi transformada em calor, sendo desconsiderada qualquer dissipação de calor, conforme:
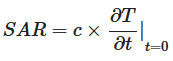
onde c é a capacidade térmica específica do meio (kJ kg −1 °C −1 ), e ![]() é o tempo derivada da temperatura, determinada em t = 0 s (°C s −1 ).
é o tempo derivada da temperatura, determinada em t = 0 s (°C s −1 ).
A SAR de cada exposição a CEM foi calculada usando a Equação ( 1 ), medindo a mudança de temperatura ao longo do tempo sob as configurações ideais (potência, temperatura e número de tratamentos). Assumiu-se que a capacidade térmica específica da suspensão celular era equivalente à da água a 25 °C, que é 4,18 kJ kg −1 °C −1 17 , 18 . Qualquer evaporação líquida que ocorreu durante as exposições a CEM foi medida em triplicado após cada uma das exposições a CEM. As amostras foram pesadas antes e depois das exposições a CEM para determinar a quantidade de água evaporada utilizando uma balança analítica (Cheetah Scientific, França).
Tratamento EMF
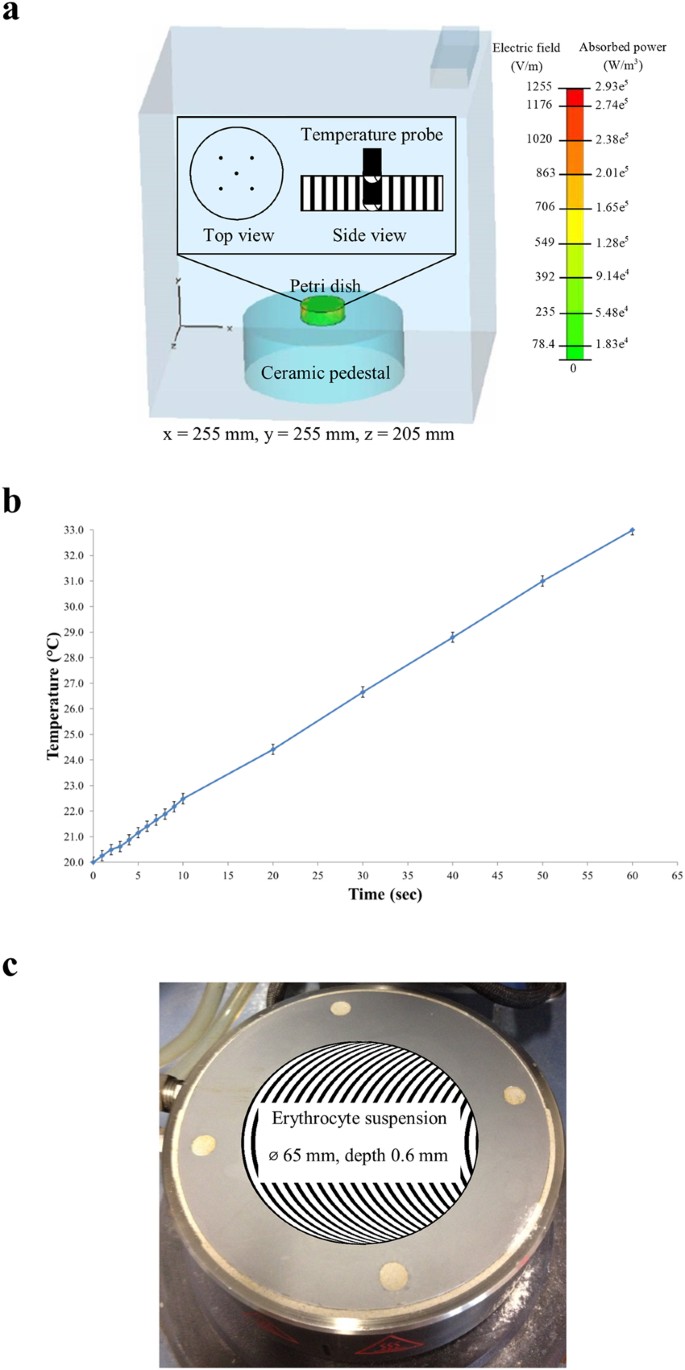
As amostras de hemácias foram submetidas a exposições a campos eletromagnéticos seguindo os procedimentos descritos em outro local 14 , 17 , 18 . Resumidamente, 2 mL das suspensões de hemácias foram submetidos a três exposições consecutivas a campos eletromagnéticos de aproximadamente 3,0 kW kg −1 SAR por exposição. O aparelho EMF utilizado para todos os experimentos foi um instrumento Vari-Wave Modelo LT 1500 (Lambda Technologies, Morrisville, NC, EUA) com frequência fixa de 18 GHz. As amostras foram colocadas em um pedestal cerâmico PD160 (Pacific Ceramics, Sunnyvale, CA, EUA, ε′ = 160, tangente de perda <10 −3) em uma posição que foi identificada, usando modelagem de campo elétrico do CST Microwave Studio 3D Electromagnetic Simulation Software (CST MWS) (CST of America, Framingham, MA, EUA), como sendo a posição que proporcionou o ambiente de aquecimento mais consistente (Fig. .5a _). O comprimento de onda calculado do EMF na água foi determinado em 2,34 mm, que é maior que as dimensões lineares de cada célula bacteriana. A profundidade de penetração foi calculada em 1,04 mm, maior que a espessura da suspensão de hemácias na placa de Petri. Assim, a possibilidade de submeter as amostras a um aquecimento desigual devido à presença de uma distribuição de campo não uniforme foi considerada insignificante. A temperatura da suspensão foi constantemente monitorada durante as exposições a CEM através de uma sonda de temperatura embutida, uma Unidade de Temperatura de Fibra Óptica Luxtron (LFOTU) (LumaSense Technologies, Santa Clara, CA, EUA) e um monitoramento térmico/infravermelho Cyclopes 330 S portátil. câmera (Minolta, Osaka, Japão). As exposições a CEM resultaram em um aumento de temperatura na amostra que variou de 20 a 37 °C (a uma taxa de aquecimento de 13 °C por min). Após a exposição, as amostras foram deixadas esfriar até 20°C em gelo (a uma taxa de 10°C por min) antes de quaisquer exposições subsequentes serem administradas. A fim de minimizar as alterações morfológicas das hemácias para menos de 10% do total de hemácias, a temperatura máxima de exposição ao EMF foi então diminuída para 33 °C (a uma taxa de aquecimento de 13 °C por min). Depois que a temperatura na amostra atingiu 33 °C, as amostras foram resfriadas até 20 °C em gelo (a uma taxa de 10 °C por min) entre as exposições. A taxa de aquecimento decorrente da exposição a CEM é mostrada na Fig. A fim de minimizar as alterações morfológicas das hemácias para menos de 10% do total de hemácias, a temperatura máxima de exposição ao EMF foi então diminuída para 33 °C (a uma taxa de aquecimento de 13 °C por min). Depois que a temperatura na amostra atingiu 33 °C, as amostras foram resfriadas até 20 °C em gelo (a uma taxa de 10 °C por min) entre as exposições. A taxa de aquecimento decorrente da exposição a CEM é mostrada na Fig. A fim de minimizar as alterações morfológicas das hemácias para menos de 10% do total de hemácias, a temperatura máxima de exposição ao EMF foi então diminuída para 33 °C (a uma taxa de aquecimento de 13 °C por min). Depois que a temperatura na amostra atingiu 33 °C, as amostras foram resfriadas até 20 °C em gelo (a uma taxa de 10 °C por min) entre as exposições. A taxa de aquecimento decorrente da exposição a CEM é mostrada na Fig. 5b . Cada etapa de otimização EMF foi validada realizando até cinco experimentos independentes, cada um realizado em triplicado, para permitir a realização de uma análise estatística dos resultados.
A distribuição de energia e o sistema de exposição do CEM de 18 GHz. ( a ) Modelagem de campo elétrico e potência absorvida usando o software de simulação eletromagnética 3D CST Microwave Studio e imagens inseridas das posições das pontas da sonda de temperatura na mídia (vista superior e lateral). ( b ) A taxa de aquecimento da suspensão de hemácias durante a exposição a CEM.
Tratamento térmico a granel
Um sistema de aquecimento/resfriamento de placa Peltier (TA Instruments, New Castle, DE, EUA) foi usado para replicar os perfis de temperatura global experimentados pelas amostras de RBC durante os experimentos de exposição a CEM, cujo método é descrito em outro lugar 14 , 17 , 18 . Resumidamente, um volume de 2 mL de suspensão de hemácias foi aplicado diretamente na plataforma de amostra da placa Peltier (Fig. 5c) .), e submetido aos mesmos perfis de temperatura em massa experimentados pelas amostras de RBC durante os experimentos de exposição a EMF. O diâmetro da plataforma de amostra da placa Peltier foi de 65 mm e a espessura da camada de suspensão de hemácias foi calculada em 0,6 mm. Todas as amostras aquecidas por placas Peltier foram estudadas em paralelo com os experimentos de exposição a CEM, com pelo menos três experimentos independentes sendo conduzidos. Suspensões de trabalho de RBC que não foram submetidas à exposição a EMF ou ao aquecimento da placa Peltier foram utilizadas como controles negativos (realizados em triplicado para cada experimento independente) para todos os experimentos.
Microscopia confocal de varredura a laser
Uma coloração de membrana lipofílica, DiI (Life Technologies, Scoresby, VIC, Austrália) foi usada para corar as amostras de hemácias para contraste. Antes de iniciar a exposição a EMF ou tratamento térmico, DiI foi adicionado às amostras a uma concentração de 5 µL por mL de suspensão celular, deixado incubar por 20 min a 37 °C e depois lavado duas vezes por centrifugação a 1300 rpm por 5 min. .
Após exposições a EMF ou tratamento térmico, as duas nanoesferas de diâmetros diferentes foram adicionadas às suspensões celulares a uma concentração de 50 µg mL-1 , deixadas incubar por 10 min e depois lavadas duas vezes usando centrifugação a 1300 rpm por 5 min. Uma alíquota de 100 µL de cada amostra foi então analisada usando um microscópio invertido Fluoview FV10i-W (Olympus, Tóquio, Japão). Aproximadamente 10 imagens CLSM por grupo de exposição a EMF foram obtidas para posterior análise estatística. Para cada imagem CLSM, o número de hemácias morfologicamente inalteradas foi contado manualmente.
Quantificação da permeabilidade celular
A capacidade de carga de nanoesferas das amostras de hemácias expostas a EMF foi quantificada usando a intensidade de fluorescência das nanoesferas de sílica que foram internalizadas pelas células usando um leitor de microplacas POLARstar Omega (BMG Labtech, Ortenberg, Alemanha). Cada amostra foi preparada de acordo com o método utilizado para análise CLSM. Uma curva de calibração foi construída para determinar a correlação da intensidade fluorescente com a concentração de nanoesferas. Foram preparadas onze concentrações de nanosferas (0,005, 0,006, 0,007, 0,008, 0,009, 0,01, 0,011, 0,012, 0,013, 0,014 e 0,015 µg mL −1 ).
A massa m de uma nanosfera de sílica foi determinada a partir da densidade da sílica ρ e do volume de uma nanosfera de sílica V , relacionado ao raio r como ![]()
Os raios dos dois tipos de nanosferas eram 11,75 × 10 −7 cm e 23,15 × 10 −7 cm (Corpuscular) e, portanto, seus volumes eram 6,8 × 10 −18 e 5,2 × 10 −17 cm 3 e massa 1,8 × 10 −17 e 1,38 × 10 −16 g, respectivamente. A massa de uma única nanosfera foi usada para calcular o número de nanosferas internalizadas.
Todas as medições de intensidade de fluorescência foram realizadas em até cinco experimentos independentes, cada um em triplicata para permitir uma análise estatística subsequente.
Microscopia Eletrônica de Varredura
Um microscópio eletrônico de varredura de emissão de campo FeSEM – SUPRA 40VP (Carl Zeiss, Jena, Alemanha), com energia de feixe primário de 3 kV, foi utilizado para obter imagens de alta resolução das amostras celulares. Uma alíquota de 100 µL de cada amostra foi colocada em uma lamínula de vidro (ProSciTech, Kirwan, Austrália), em duplicata, e deixada em repouso por 10 min. Todas as amostras foram então fixadas em glutaraldeído 2,5% (Sigma) por 30 min e desidratadas progressivamente usando soluções graduadas de etanol (30, 50, 70, 90 e 100% v/v) por 10 min. As lamínulas de vidro foram secas ao ar e depois submetidas a pulverização catódica de ouro (película de ouro de 6 nm de espessura) usando um instrumento NeoCoater MP-19020NCTR (JEOL, Frenchs Forest, Austrália). Aproximadamente trinta imagens SEM para cada etapa experimental foram obtidas com uma ampliação de 3.000× para posterior análise estatística. Para cada imagem SEM,
Microscopia Eletrônica de Transmissão
As nanoesferas de 46,3 nm foram adicionadas às suspensões celulares após terem sido submetidas às exposições EMF e depois sedimentadas utilizando centrifugação a 1300 rpm durante 5 min a 25 °C. As células foram então lavadas duas vezes com PBS 10 mM a um pH de 7,4 para remover quaisquer nanoesferas que não tivessem sido internalizadas pelas células. Os pellets resultantes foram então suspensos em 2 mL de glutaraldeído a 1% em PBS durante 30 min e depois lavados duas vezes em PBS durante 5 min. Após a etapa final de lavagem, as suspensões celulares foram adicionadas a 0,5 mL de gel de agarose a 3% fundido, perfurando o gel com a ponta da pipeta. O ágar foi então imediatamente resfriado a 4 ° C por refrigeração por 30 min e então a área contendo a suspensão celular foi cortada da área total do ágar. As amostras contendo a suspensão celular foram lavadas duas vezes em H 2 nanopuroO (com resistividade de 18,2 MW cm −1 ) por 15 min cada. As amostras foram então desidratadas passando-as através de uma série graduada de etanol (20, 40 e 60%) (2 mL) por 15 min e depois coradas por 8 h com acetato de uranila 2% em etanol 70% (2 mL). Após a coloração, as células foram ainda desidratadas passando as amostras por outra série graduada de etanol (80, 90 e 100%) por 15 min cada (2 mL).
O meio de incorporação foi preparado utilizando resina de ouro LR (ProSciTech). Para incorporar as amostras, cada amostra de ágar contendo a suspensão celular foi incubada em 2 mL de etanol 100% e monômero de ouro LR (proporção 1:1) por 8 h, seguido de transferência para etanol 100% e monômero de ouro LR ( Proporção de 1:3) por 8 h e, finalmente, uma transferência para o monômero de ouro LR puro por 8 h. Cada amostra foi então transferida para uma cápsula de gelatina contendo monômero de ouro LR fresco misturado com 1% de peróxido de benzoíla seco, que foi então polimerizado por 24 horas a 4 °C. O bloco final foi aparado e depois cortado em seções ultrafinas (70 nm de espessura) usando um Ultramicrótomo Leica EM UC7 (Leica Microsystems, Wetzlar, Alemanha) com uma faca de diamante (Diatome, Pensilvânia, EUA). As seções foram colocadas em grades de cobre de malha 200 e examinadas usando um instrumento JEM 1010 (JEOL).
Análise estatística
Todo o processamento estatístico dos dados foi realizado utilizando o software SPSS 22.0 (SPSS, Chicago, IL, EUA).
Referências
-
Le Quément, C. et ai . Análise da expressão do genoma completo em culturas primárias de células de queratinócitos humanos expostas à radiação de 60 GHz. Bioeletromagnética. 33 , 147–158 (2012).
-
Aitken, RJ, Bennetts, LE, Sawyer, D., Wiklendt, AM & King, BV Impacto da radiação eletromagnética de radiofrequência na integridade do DNA na linhagem germinativa masculina. Internacional J. Androl. 28 , 171–179 (2005).
-
Li, G. et ai . Efeitos genéticos de descargas luminosas de radiofrequência e pressão atmosférica com hélio. Apl. Física. Vamos . 92 (2008).
-
Ruediger, HW Efeitos genotóxicos de campos eletromagnéticos de radiofrequência. Fisiopatologia. 16 , 89–102 (2009).
-
Ruiz-Gómez, MJ & Martínez-Morillo, M. Campos eletromagnéticos e a indução de quebras na cadeia de DNA. Eletromagnético. Biol. Med. 28 , 201–214 (2009).
-
George, DF, Bilek, MM e McKenzie, DR Efeitos não térmicos no desdobramento de proteínas induzido por microondas observado pela ligação de acompanhantes. Bioeletromagnética. 29 , 324–330 (2008).
-
Bohr, H. & Bohr, J. Cinética aprimorada por microondas observada em estudos ORD de uma proteína. Bioeletromagnética. 21 , 68–72 (2000).
-
Laurence, JA, French, PW, Lindner, RA & McKenzie, DR Efeitos biológicos de campos eletromagnéticos – Mecanismos para os efeitos da radiação de microondas pulsada na conformação de proteínas. J. Teor. Biol. 206 , 291–298 (2000).
-
Gurisik, E., Warton, K., Martin, DK & Valenzuela, SM Um estudo in vitro dos efeitos da exposição a um sinal GSM em duas linhagens de células humanas: Monocytic U937 e neuroblastoma SK-N-SH. Biol celular. Internacional 30 , 793–799 (2006).
-
Bohr, H. & Bohr, J. Dobramento e desnaturação de proteínas globulares melhoradas por microondas. Física. Rev. Física. Plasmas. Fluidos. Relativo. Interdisciplinar. Tópicos. 61 , 4310–4314 (2000).
-
Inhan-Garip, A. et al . Efeito de campos eletromagnéticos de frequência extremamente baixa na taxa de crescimento e morfologia das bactérias. Internacional J. Radiat. Biol. 87 , 1155–1161 (2011).
-
Cohen, I., Cahan, R., Shani, G., Cohen, E. & Abramovich, A. Efeito da radiação eletromagnética de onda milimétrica contínua de 99 GHz na viabilidade e atividade metabólica de E. coli . Internacional J. Radiat. Biol. 86 , 390–399 (2010).
-
Celandroni, F. et ai . Efeito da radiação de microondas nos esporos de Bacillus subtilis . J. Appl. Microbiol. 97 , 1220–1227 (2004).
-
Shamis, Y. et ai . Efeitos eletromagnéticos específicos da radiação de microondas em Escherichia coli . Apl. Meio Ambiente. Microbiol. 77 , 3017–3022 (2011).
-
Banik, S., Bandyopadhyay, S. & Ganguly, S. Bioefeitos de microondas – Uma breve revisão. Biorrecurso. Tecnologia. 87 , 155–159 (2003).
-
Rai, S. et ai . Efeito das frequências moduladas de microondas na fisiologia de uma cianobactéria. Anabaena doliolum. Eletromagnético. Biol. Med. 18 , 221–232 (1999).
-
Nguyen, THP et al . O campo eletromagnético de 18 GHz induz permeabilidade de cocos Gram-positivos. Ciência. Rep. 5 , 10980 (2015).
-
Nguyen, THP et al . Os bioefeitos resultantes da exposição de células procarióticas e leveduras a um campo eletromagnético de 18 GHz. PLoS ONE 11 , e0158135 (2016).
-
Stoll, C. & Wolkers, WF Estabilidade da membrana durante a biopreservação de células sanguíneas. Transfusão. Med. Hemãe. 38 , 89–97 (2011).
-
Magnani, M. Engenharia de eritrócitos para distribuição e direcionamento de medicamentos. (Springer EUA, 2003).
-
Tan, S., Wu, T., Zhang, D. & Zhang, Z. Sistemas de distribuição de medicamentos baseados em células ou membranas celulares. Teranósticos 5 , 863–881 (2015).
-
Bourgeaux, V., Lanao, JM, Bax, BE & Godfrin, Y. Eritrócitos carregados de medicamentos: no caminho para a aprovação de comercialização. Droga Des. Dev. Lá. 10 , 665–676 (2016).
-
Vodyanoy, V. Avaliação termodinâmica de vesículas liberadas por eritrócitos em temperaturas elevadas. Colóides. Surfar. B. Biointerfaces. 133 , 231–238 (2015).
-
Ivanov, IT, Brähler, M., Georgieva, R. & Bäumler, H. Papel das proteínas de membrana no dano térmico e necrose dos glóbulos vermelhos. Termochim. Acta 456 , 7–12 (2007).
-
Parshina, EY et al . Inativação térmica do cotransporte K + , Cl − sensível ao volume e alterações no alívio da membrana plasmática em eritrócitos humanos. Arco Pflugers. EUR. J. Fisiol. 465 , 977–983 (2013).
-
Zarkowsky, HS Fragmentação de eritrócitos induzida por calor na eliptocitose neonatal. Ir. J. Hematol. 41 , 515–518 (1979).
-
Pogodin, S., Werner, M., Sommer, J.-U. & Baulin, VA Permeabilidade induzida por nanopartículas de membranas lipídicas. Acs Nano 6 , 10555–10561 (2012).
-
Liu, F., Burgess, J., Mizukami, H. & Ostafin, A. Preparação de amostras e imagem do citoesqueleto eritrocitário com microscopia de força atômica. Bioquímica Celular. Biofísica. 38 , 251–270 (2003).
-
Verma, A. & Stellacci, F. Efeito das propriedades da superfície nas interações nanopartículas-células. Pequeno 6 , 12–21 (2010).
-
Shamis, Y., Croft, R., Taube, A., Crawford, RJ e Ivanova, EP Revisão dos efeitos específicos da radiação de microondas nas células bacterianas. Apl. Microbiol. Biotecnologia. 96 , 319–325 (2012).
-
Harisa, GD, Ibrahim, MF e Alanazi, FK Caracterização de eritrócitos humanos como potencial transportador de pravastatina: um estudo in vitro . Internacional J. Med. Ciência 8 , 222–230 (2011).
-
Ohvo-Rekila, H., Ramstedt, B., Leppimaki, P. & Slotte, JP Interações do colesterol com fosfolipídios nas membranas. Programa. Res lipídicos. 41 , 66–97 (2002).
-
Muzykantov, VR Administração de medicamentos pelos glóbulos vermelhos: transportadores vasculares concebidos pela mãe natureza. Opinião de especialistas. Droga Deliv. 7 , 403–427 (2010).
-
Hansen, JC, Skalak, R., Chien, S. & Hoger, A. Influência da topologia de rede na elasticidade do esqueleto da membrana dos glóbulos vermelhos. Biofísica. J. 72 , 2369–2381 (1997).
Artigo CAS PubMed PubMed Central PUBLICIDADES Google Scholar
-
English, NJ e MacElroy, JMD Simulações de dinâmica molecular de aquecimento de água por microondas. J. Química. Física. 118 , 1589–1592 (2003).
-
Adair, RK Ressonâncias vibracionais em sistemas biológicos em frequências de microondas. Biofísica. J. 82 , 1147–1152 (2002).
Artigo CAS PubMed PubMed Central PUBLICIDADES Google Scholar
-
Shamis, Y., Ivanova, E., Alex, T., Croft, R. & Crawford, R. Influência da radiação de microondas de 18 GHz na atividade enzimática de Escherichia coli lactato desidrogenase e citocromo c oxidase. J. Física. Ciência. Apl. 2 , 143–151 (2012).
-
Soghomonyan, D. & Trchounian, A. Efeitos comparáveis da irradiação eletromagnética de baixa intensidade na frequência de 51,8 e 53 GHz e do antibiótico ceftazidima no crescimento e sobrevivência de Lactobacillus acidophilus . Bioquímica Celular. Biofísica. 67 , 829–835 (2013).
-
Torgomyan, H., Ohanyan, V., Blbulyan, S., Kalantaryan, V. & Trchounian, A. Irradiação eletromagnética de Enterococcus hirae em frequências de baixa intensidade de 51,8 e 53,0 GHz: mudanças nas propriedades da membrana celular bacteriana e antibióticos aprimorados efeitos. FEMS Microbiol. Vamos. 329 , 131–137 (2012).
-
Torgomyan, H., Tadevosyan, H. & Trchounian, A. A irradiação eletromagnética de frequência extremamente alta em combinação com antibióticos aumenta os efeitos antibacterianos em Escherichia coli . Curr. Microbiol. 62 , 962–967 (2011).
-
Torgomyan, H. & Trchounian, A. Escherichia coli processos dependentes de energia associados à membrana e sensibilidade a antibióticos mudam como respostas à irradiação eletromagnética de baixa intensidade de frequências de 70,6 e 73 GHz. Bioquímica Celular. Biofísica. 62 , 451–461 (2012).
-
Ginn, FL, Hochstein, P. & Trump, BF Alterações da membrana na hemólise: Internalização do plasmalema induzida pela primaquina. Ciência. 164 , 843–845 (1969).
-
Panagopoulos, DJ, Johansson, O. & Carlo, GL Avaliação da taxa de absorção específica como quantidade dosimétrica para bioefeitos de campos eletromagnéticos. PLoS ONE 8 , e62663 (2013).
Artigo CAS PubMed PubMed Central PUBLICIDADES Google Scholar
Reconhecimentos
Os autores gostariam de agradecer a Debbie Lane, gerente do Animal House, Monash University, Melbourne, Austrália, pela assistência técnica. Os autores também gostariam de agradecer a assistência técnica do Centro Australiano de Pesquisa em Microscopia e Microanálise do Centro de Microscopia e Microanálise da Universidade RMIT (RMMF). Este trabalho foi parcialmente apoiado pelo Centro Australiano de Pesquisa de Bioefeitos Eletromagnéticos (ACEBR), um Centro de Excelência em Pesquisa do Conselho Nacional de Saúde e Pesquisa Médica (NHMRC). Os autores não têm relacionamento financeiro ou pessoal com outras pessoas ou organizações que possam influenciar indevidamente este trabalho.
Informação sobre o autor
Autores e Afiliações
-
Faculdade de Ciências, Engenharia e Tecnologia, Swinburne University of Technology, Hawthorn, Vic, 3122, Austrália
Hong Phong Nguyen, Vy TH Pham e Elena P. Ivanova
-
Departamento de Engenharia Química, Universidade Rovira I Virgili, 26 Av. dels Paisos Catalães, 43007, Tarragona, Espanha
Vladimir Baulin
-
Escola de Psicologia, Illawarra Health & Medical Research Institute, University of Wollongong, Wollongong, NSW, 2522, Austrália
Rodney J. Croft
-
Centro Australiano de Pesquisa de Bioefeitos Eletromagnéticos, Wollongong, NSW, 2522, Austrália
Rodney J. Croft e Elena P. Ivanova
-
Escola de Ciências, Universidade RMIT, Melbourne, Vic, 3001, Austrália
Russel J. Crawford
Contribuições
Concebeu o projeto: EPI Projetou os experimentos: EPI, THPN Realizou os experimentos: THPN, VTHP Analisou os dados: EPI, RJC Escreveu o artigo: TPHN, VB, RJC, RJC, EPI
autor correspondente
Correspondência para Elena P. Ivanova .
Declarações éticas
Interesses competitivos
Os autores declaram não ter interesses conflitantes.
Informações adicionais
Nota do editor: A Springer Nature permanece neutra em relação a reivindicações jurisdicionais em mapas publicados e afiliações institucionais.
Material complementar eletrônico
Direitos e permissões
Acesso aberto
Este artigo está licenciado sob uma Licença Internacional Creative Commons Atribuição 4.0, que permite o uso, compartilhamento, adaptação, distribuição e reprodução em qualquer meio ou formato, desde que você dê o devido crédito ao(s) autor(es) original(is) e à fonte, forneça um link para a licença Creative Commons e indique se foram feitas alterações. As imagens ou outros materiais de terceiros neste artigo estão incluídos na licença Creative Commons do artigo, salvo indicação em contrário na linha de crédito do material. Se o material não estiver incluído na licença Creative Commons do artigo e o uso pretendido não for permitido por regulamentação legal ou exceder o uso permitido, você precisará obter permissão diretamente do detentor dos direitos autorais. Para visualizar uma cópia desta licença, visitehttp://creativecommons.org/licenses/by/4.0/ .
- O Hong Phong Nguyen ,
- Por TH Pham ,
- Vladimir Baulin ,
- Rodney J. Croft ,
- Russel J. Crawford e
- Elena P. Ivanova
Relatórios Científicos volume 7 , Número do artigo: 10798 ( 2017 ) Citar este artigo
-
13 mil acessos
-
15 citações
-
30 Altmétrico